Ю.Л. Шевченко
Аннотация
В основе сердечной недостаточности, как правило, лежит повреждение кардиомиоцитов. При этом наиболее частой причиной дисфункции миокарда являются ИБС, различные воспалительные процессы, чрезмерные физические перегрузки, в том числе при приобретенных и врожденных пороках сердца и прочее. Однако нередко встречаются больные с сердечной недостаточностью, у которых перечисленные причины отсутствуют и не подтверждаются ни инструментальными, ни лабораторными исследованиями. Лечение таких больных неэффективно. Многолетняя клиническая практика, многочисленные научно-экспериментальные исследования позволили предположить, что причиной подобной дисфункции миокарда является иммобилизирующий интерстициальный фиброз сердца.
Заключение. Иммобилизирующий интерстициальный фиброз сердца можно считать самостоятельной патологией и одной из главных причин развития сердечной недостаточности. В основе лежит процесс изменения соединительнотканного каркаса миокарда, приводящий к угнетению работы сердца.
Ключевые слова: сердечная недостаточность, иммобилизация, соединительная ткань, интерстициальный фиброз.
Immobilizing interstitial cardiac fibrosis. A new concept of the pathogenesis of chronic heart failure
Yu.L. Shevchenko
Abstract
Heart failure is usually based on damage to cardiomyocytes. At the same time, the most common cause of myocardial dysfunction are coronary heart disease, various inflammatory processes of the muscle, excessive physical overload, including acquired and congenital heart defects, and so on. However, it is not uncommon to meet patients with chronic heart failure, in which the listed causes are absent and are not confirmed by either instrumental or laboratory studies. Treatment of such patients is usually ineffective. Long-term clinical practice, numerous scientific and experimental studies have suggested that the cause of such myocardial dysfunction is the immobilizing interstitial fibrosis of the heart.
Conclusion. The immobilizing interstitial fibrosis of the heart can be considered an independent pathology and one of the main causes of the development of heart failure. It is based on the process of changing the connective tissue framework of the myocardium, resulting in the suppression of its work.
Keywords: heart failure, immobilization, connective tissue, interstitial fibrosis.
Введение
Наиболее частой причиной недостаточности кровообращения является сердечная недостаточность, в основе которой лежит нарушение сократительной способности кардиомиоцитов. Их дисфункция чаще всего обусловлена ишемической болезнью сердца, воспалительными процессами разной этиологии, чрезмерными физическими перегрузками, в том числе при врожденных и приобретенных пороках, нарушениями метаболизма с электролитными расстройствами, интоксикациями, ушибами сердца, опухолями и прочее.
Однако клиническая практика весьма богата наблюдениями пациентов с выраженной сердечной недостаточностью при отсутствии вышеперечисленных причин и явных признаков поражения собственно миокарда, что подтверждается инструментальными и лабораторными данными (электрокардиография, эхокардиография, сцинтиграфия, коронарография, лабораторные маркеры и прочее).
При этом особенностью попыток лечения таких пациентов является неэффективность терапии сердечной недостаточности. Ни сердечные гликозиды, ни прямые кардиотонические препараты, ни мочегонные, ни прочие известные лекарственные средства не дают значимого клинического эффекта. В итоге при диагностическом заключении сердечная недостаточность объясняется кардиомиопатией с пессимистичным прогнозом.
Вместе с тем врачу трудно представить недостаточность сердечной деятельности без повреждения собственно миокарда, его анатомо-физиологической структурной единицы — кардиомиоцита. Тем не менее, этот факт существует, но остается вне поля зрения клиницистов и исследователей.
Многолетняя клиническая практика, многочисленные научно-экспериментальные исследования, особенно, макро- и микроморфологические, всесторонний анализ и сопоставление различных выявляемых фактов, позволили предположить, что причиной дисфункции миокарда, когда не определяется иная этиология, объясняющая сердечную недостаточность, с большей вероятностью может быть механический фактор, находящийся за пределами миокардиальных пучков здоровых кардиомиоцитов, но структурно тесно связанный с ними. Таким фактором является межуточная соединительная ткань с измененными физическими свойствами: чрезмерным ее уплотнением, что препятствует нормальному функционированию кардиомиоцитов, т.е. происходит их иммобилизация.
Таким образом, речь идет об иммобилизирующем интерстициальном фиброзе сердца как самостоятельной причине сердечной недостаточности.
Морфология и физиология интерстициальной соединительной ткани сердца
Кардиомиоциты и их пучки окружены эндомизием и перимизием, основу которых представляют волокнистая соединительная ткань (коллагеновые волокна I, III, VI и XII типов) и межклеточное вещество, содержащее гликопротеины, гликозаминогликаны, протеогликаны, факторы роста и протеазы, которые могут быть активированы после повреждения для репарации (рисунок 1) [1;2].

Рисунок 1. Норма. Кардиомиоциты окружены тонкими прослойками соединительной ткани (окраска по Массон, увеличение х400)
В соединительной ткани миокарда выявляются эндотелиальные, иммунные клетки (макрофаги, тучные и дендритные), клетки стенок сосудов (гладкомышечные и перициты)
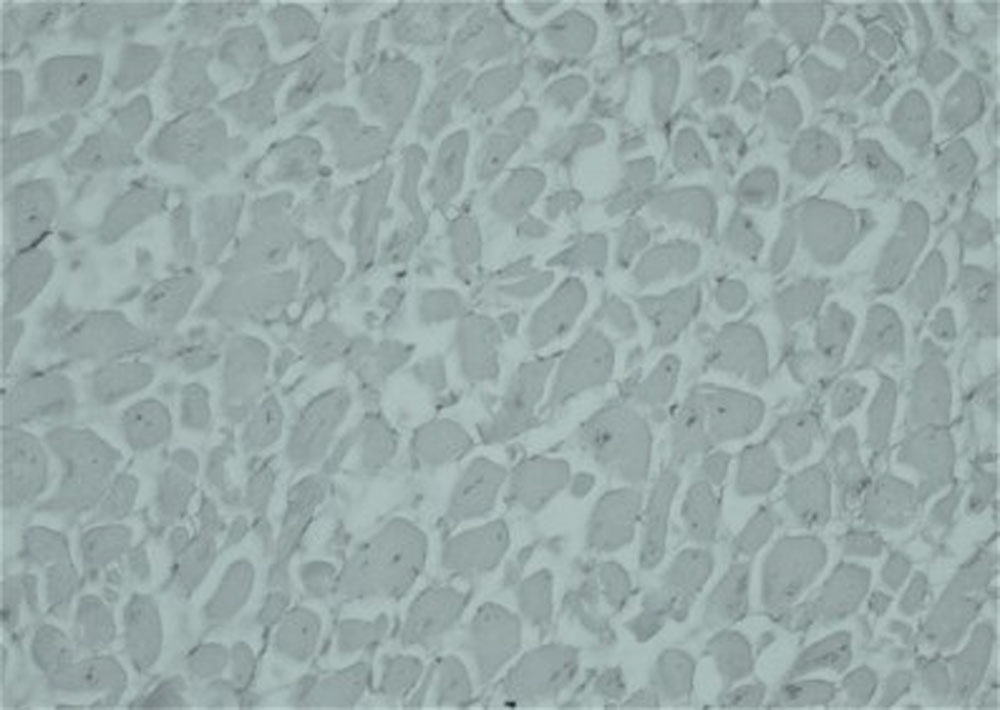
Рисунок 2. Норма. Тонкие, равномерные слои коллагеновых волокон в межуточной соединительной ткани миокарда (окраска по Вейгерту, увеличение х400)
Благодаря такому рациональному устройству соединительной ткани обеспечивается структурная и функциональная целостность миокарда: формируется каркас и становится возможным беспрепятственное скольжение клеток и их пучков относительно друг друга. Интрамиокардиальные фасции обеспечивают спиральную «закрутку» сердца при систоле, что увеличивает силу и способствует энергетически экономному и эффективному его сокращению.
В здоровом сердце в межклеточном веществе поддерживается баланс между синтезом и деградацией белков, осуществляются механизмы реорганизации этой структуры [10;11]. Нарушение баланса приводит к неблагоприятным последствиям. Вначале направленный на защиту и восстановление структуры сердца синтез соединительной ткани постепенно приобретает патологический характер: изменяется архитектоника ткани, электрическая проводимость, снижается сократимость миокарда, прогрессирует сердечная недостаточность, это приводит к нарушению межклеточного взаимодействия, к возникновению злокачественных аритмий и внезапной сердечной смерти [7;12;13].
В литературе есть сведения о трех различных формах фиброзного поражения сердца по данным гистологических исследований:
«Заместительный» — фиброз, который возникает при инфаркте миокарда, выполняет репаративную функцию. Гибель значительного количества кардиомиоцитов стимулирует воспаление и последующую активацию фибробластов, что приводит к образованию рубца, который поддерживает структурную целостность стенки сердца, а в случае трансмурального инфаркта — предотвращает катастрофические механические осложнения в виде разрыва (рисунок 3)
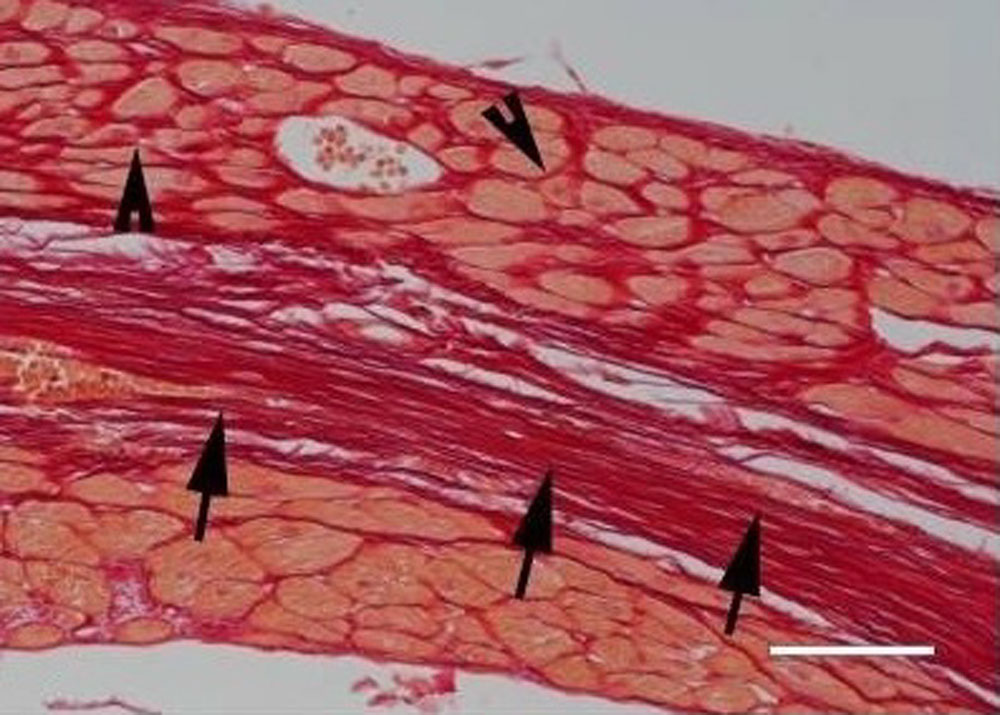
Рисунок 3. Заместительный фиброз — инфаркт миокарда, кардиомиоциты замещаются рубцом (гистологический препарат сердца мыши, окрашенный пикросириусом красным, масштабная линейка = 80 мкм)
«Интерстициальный фиброз» сопровождается расширением эндомизиального и перимизиального пространств, вызван суммарным накоплением белков внеклеточного матрикса при воспалительных процессах в миокарде и связан с системным склерозом (рисунок 4) [16].
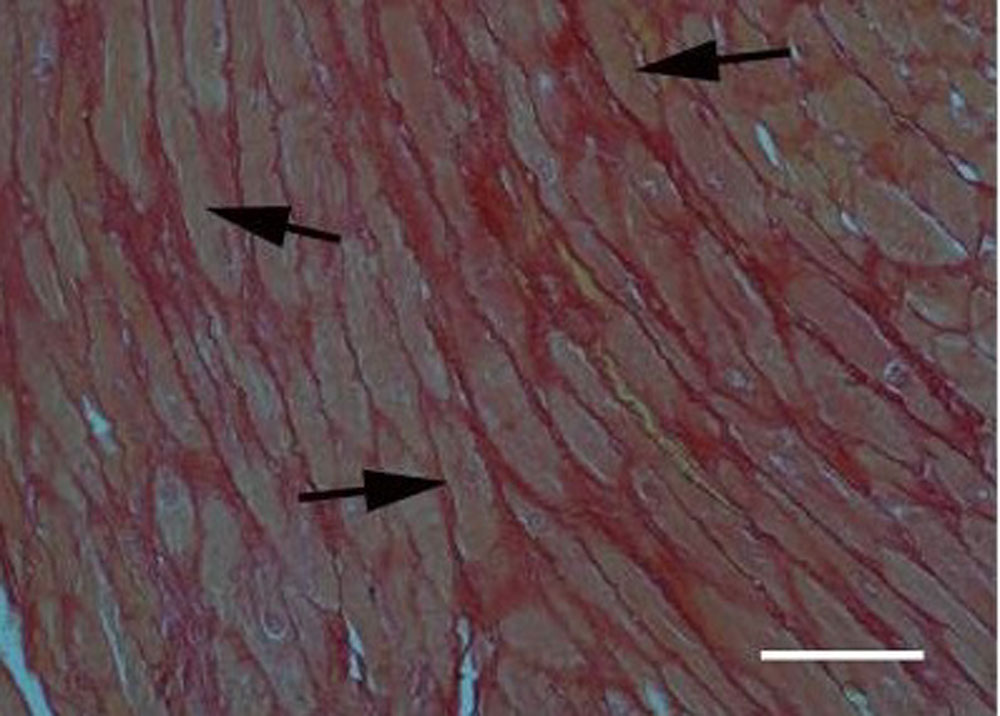
Рисунок 4. Интерстициальный фиброз (указано стрелками) на модели перегрузки давлением левого желудочка, при сужении аорты (7 дней) (гистологический препарат сердца мыши, окрашенный пикросириусом красным, масштабная линейка = 80 мкм)
«Периваскулярный фиброз» может быть результатом длительной активации фиброгенных стимулов и представляет собой первичные повреждающие процессы при гипертонической болезни сердца. Отражает конверсию фибробластов или фиброгенную активацию эндотелиальных и пристеночных клеток сосудов (рисунок 5)
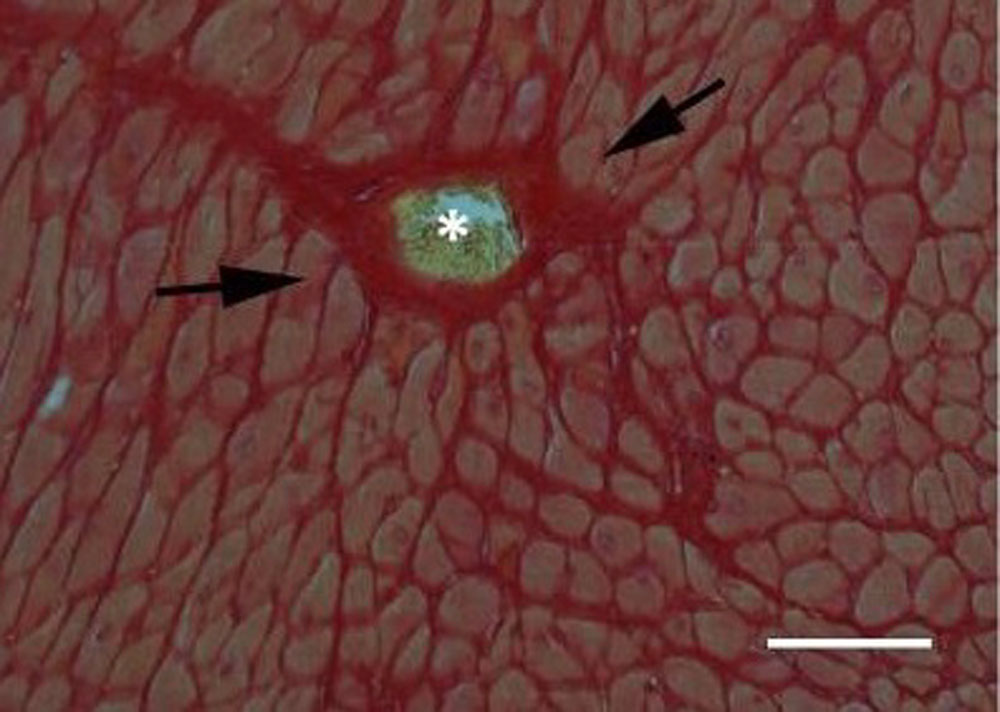
Рисунок 5. Периваскулярный фиброз (указано стрелками), большое количество коллагена, окружающее сосуд (*) (гистологический препарат сердца мыши, окрашенный пикросириусом красным, масштабная линейка = 80 мкм)
Перегрузка камер сердца давлением и объемом, сахарный диабет, нарушение липидного обмена при ожирении и многие другие причины влияют на изменения в регуляции синтеза коллагеновых волокон, прогрессирующим интерстициальным и периваскулярным фиброзом, что становится типичным проявлением различных кардиомиопатий (рисунок 6) [21].
![Рисунок 6. Вторичная кардиомиопатия при декомпенсированном аортальном пороке. Выраженный кардиосклероз и гипертрофия кардиомиоцитов (окраска гематоксилин и эозин, увеличение х400) [22]](/etc/2022/pic7108.jpg)
Рисунок 6. Вторичная кардиомиопатия при декомпенсированном аортальном пороке. Выраженный кардиосклероз и гипертрофия кардиомиоцитов (окраска гематоксилин и эозин, увеличение х400) [22]
Анатомия и физиология сердца при иммобилизирующем интерстициальном фиброзе
Проведенные многочисленные экспериментальные и клинические исследования позволили сделать вывод, что встречается изолированное нарушение структуры эндомизия и перимизия, с тенденцией к уплотнению и постепенному механическому сдавлению кардиомиоцитов — иммобилизации. Причем этот медленный процесс достигает такой степени огрубления, что образуется каркас вокруг пучков и отдельных кардиомиоцитов, препятствующий сначала полноценной диастоле, а в дальнейшем и систоле. В этой связи и предложен термин: «иммобилизирующий интерстициальный фиброз сердца». Отличительной особенностью этой отдельной нозологической формы является тотальное, диффузное поражение соединительной ткани (отсутствие локальных зон поражения, характерных для других известных форм фиброза).
Аналогией этого процесса может служить загипсованная для сращения отломков конечность, когда длительная иммобилизация приводит к атрофии мышц и формированию контрактуры.
Но более близкой моделью иммобилизации является констриктивный перикардит, при котором через воспаление происходит постепенное уплотнение эпикарда и перикарда с формированием грубого соединительнотканного «каркаса», вплоть до сдавливающего сердце «панциря» («панцирного сердца») (видео 1,2).
Видео 1. Процесс формирования «панцирного сердца» при констриктивном перикардите
Видео 2. Констриктивный перикардит, формирование грубого соединительнотканного «каркаса»
Этот принцип правомерно может быть перенесен на клеточный уровень, т.е. на отдельные кардиомиоциты и их пучки: в основе нарушения функции сократительного аппарата при иммобилизирующем интерстициальном фиброзе сердца лежит механическая причина — сдавление клеток и их ассоциаций извне — уплотнение паракардиомиоцитарного каркаса (видео 3).
Видео 3. Увеличение количества и плотности соединительной ткани с иммобилизацией пучков кардиомиоцитов (жёлтым выделена уплотненная соединительная ткань)
Следует отметить, что в этой ситуации нарушается очень важный элемент в механике сокращения сердца в целом. Грубый фиброз специфической конструкции интрамиокардиальных фасций препятствует в систолической фазе эффекту спиральной «закрутки», что значительно повышает нагрузку на миокард и изменяет конфигурацию внутрисердечной гемодинамики (рисунок 7).
![Рисунок 7. А — Пространственное расположение миокарда желудочков в виде спирали, состоящей из 2-х витков. Ао — аорта, ЛА — легочная артерия, ПС — правый сегмент, ЛС — левый сегмент, НС — нисходящий сегмент, ВС — восходящий сегмент. В центре имеется сгиб (под углом около 180 градусов), который разделяет базальный и верхушечный циклы. Базальный цикл (ПС — свободная стенка ПЖ от корня ЛА до МЖП; ЛС — свободная стенка ЛЖ от МЖП до центрального сгиба) имеет направление от корня ЛА к центральному сгибу, а верхушечный цикл направлен от сгиба до корня аорты. Переход нисходящего сегмента в восходящий происходит под углом около 90 градусов. Схема последовательности вращения сегментов верхушечного цикла в норме. Б — сокращение нисходящего сегмента полосы: укорочение длинной оси желудочков, циклический сдвиг, изменение размера и формы АВ отверстий. В — сокращение восходящего сегмента: резкое удлинение продольной оси желудочка раскручивание основания, увеличение размера и изменения формы АВ отверстий. В результате, создается мощная сила всасывания предсердной крови [23;24]. При иммобилизирующем интерстициальном фиброзе эти процессы нарушаются](/etc/2022/pic7110.jpg)
Рисунок 7. А — Пространственное расположение миокарда желудочков в виде спирали, состоящей из
В силу различных причин (вирусные заболевания, токсические или лучевые воздействия, а также различной природы аутоиммунные процессы в организме и др.) изменяется молекулярный фенотип соединительной ткани сердца с повышением экспрессии фиброгенных медиаторов, усиливается синтез коллагеновых волокон и нарушается их соотношение, происходит ремоделирование внеклеточного матрикса с формированием сетевидных каркасных структур, окружающих отдельные здоровые кардиомиоциты.
Высокая реактивность (системный воспалительный ответ) соединительной ткани способствует порой ее выраженному отеку. При этом в процесс может вовлекаться лимфатическая система сердца с нарушением лимфодренажа и последующим склерозированием мелких лимфатических сосудов, образуется с измененными эндомизием и перимизием общий межуточный соединительнотканный конгломерат.
Так как вначале кардиомиоциты остаются интактными, сократительная способность сердца не изменяется. Но с постепенным уплотнением соединительной ткани она препятствует полноценному расслаблению клеток, в связи с этим начинает страдать диастолическая функция сердца. Миогенная сердечная ауторегуляция (закон Франка-Старлинга) в этих условиях перестает функционировать. Не происходит приспособление работы желудочков сердца к увеличению нагрузки объемом, не уравнивается производительность левого и правого желудочков сердца, не обеспечивается оптимальное количество циркулирующей крови и поддержание необходимого артериального давления (видео 4,5,6).
Видео 4. Схематическое изображение иммобилизации отдельных кардиомиоцитов. А — нормальная структура соединительной ткани (коллагеновый волокна, межклеточное вещество, встречаются единичные фибробласты); Б — увеличение количества фибробластов, коллагена I и III типа; появление металлопротеиназ; лимфостаз за счет склерозирования лимфатических сосудов, ограничивается диастолическая функция; В — формирование иммобилизирующего «каркаса» (преобладание «грубых» коллагеновых волокон I типа), ограничение систолы и диастолы кардиомиоцитов
Видео 5. Схематическое изображение иммобилизации пучков кардиомиоцитов. А — норма, нормальное сокращение пучков кардиомиоцитов, Б — выраженное уплотнение межуточной соединительной ткани, иммобилизация ассоциаций кардиомиоцитов до ограничения диастолы, В — тяжелая степень фиброза, ограничение диастолы и систолы
Видео 6. Разные стадии развития иммобилизирующего фиброза (от начальных проявлений до выраженных)
Позже с еще более выраженным уплотнением соединительной ткани происходит «сковывание» кардиомиоцитов до такой степени, что ухудшается систолическая функция правого и левого желудочков. Сердечная недостаточность приводит к развитию общей недостаточности кровообращения.
По мере усугубления фиброза происходит сдавление периферических отделов венечных артерий, причем процесс начинается с артериол, у которых мышечный слой слабо выражен. В это время могут появляться клинические, инструментальные признаки коронарной недостаточности, при этом не происходит ответа на спазмолитические препараты. Развивается ангиопатия в результате сдавления артерии извне — соединительная ткань как муфта окутывает их. Проявляется весьма специфичный ангиографический симптом — «мышиных хвостов». Этот признак известен давно, чаще его связывали с аномалиями развития коронарных артерий — их гипоплазией. На этой стадии возможны тромбозы венечного русла и, как результат, развитие инфарктов миокарда (рисунки
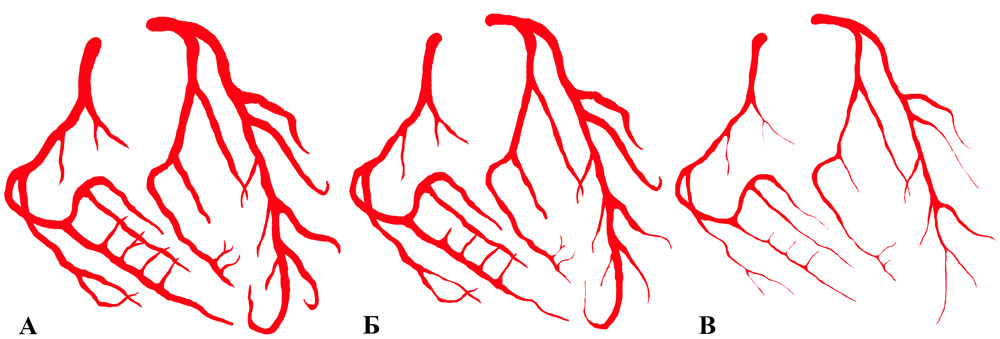
Рисунок 8. Схема последовательного развития периваскулярного стенозирующего фиброза: А — коронарное русло в норме, Б — начальные процессы периваскулярной иммобилизации, страдает периферическое русло, В — далеко зашедший интерстициальный фиброз с формированием признака «мышиных хвостов»
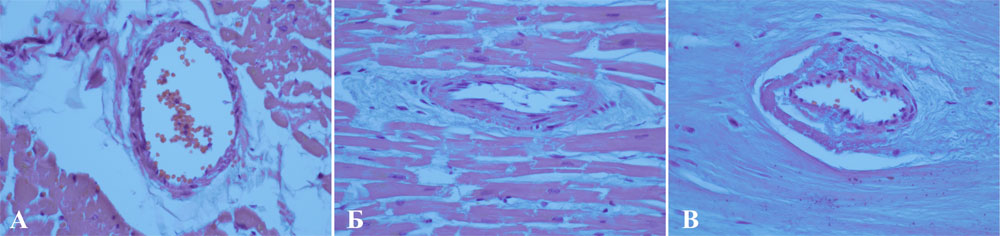
Рисунок 9. Развитие периваскулярной иммобилизации: А — норма, Б — выраженный фиброз с умеренной иммобилизацией сосуда, В — тяжелая степень фиброза со значительным сдавлением коронарной артериолы (окраска гематоксилин и эозином, увеличение х400)
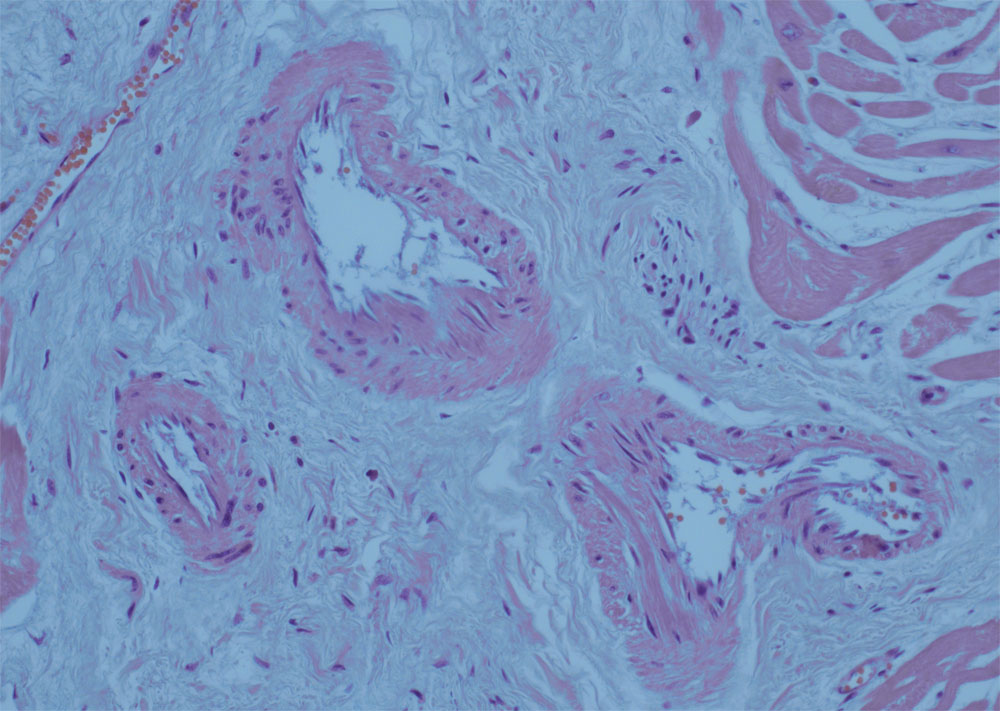
Рисунок 10. Группа суженных сосудов при тяжелой степени фиброза (окраска гематоксилин и эозином, увеличение х400)
Морфологические основы иммобилизирующего интерстициального фиброза сердца
Накоплен и проанализирован обширный материал прижизненных биопсий сердца и секционных исследований людей разных возрастов, в том числе новорожденных, умерших в разные сроки. Выявлена группа пациентов с интерстициальным иммобилизирующим фиброзом — выраженным уплотнением эндомизия и перимизия неишемического генеза.
Установлено, что в основе этих процессов лежит нарушение белкового обмена, изменение соотношения коллагеновых волокон различных типов. Основной морфологический субстрат фиброза миокарда — стимуляция синтеза коллагенов I и III типов, кроме того, увеличение происходит не пропорционально: коллагена I типа значительно больше (это является ключевым в оценке «жесткости» соединительной ткани).
Структурирован коллаген I типа в виде сеток и пересекающихся пучков, образующих замкнутые пространства вокруг отдельных кардиомиоцитов. Такой каркас также включает более многочисленные пучки волокон коллагена III типа, расположенные хаотично без четко различимых пространственных структур. Обращает на себя внимание морфологическое сходство со структурой келоидного рубца, образующегося иногда после ожогов, заживления послеоперационных ран и т.д. (рисунки 11-13).

Рисунок 11. Иммобилизирующий интерстициальный фиброз сердца, начальные изменения соединительной ткани, увеличение количества коллагена I (А) и III (Б) типов (окраска по Вейгерту, увеличение х400)
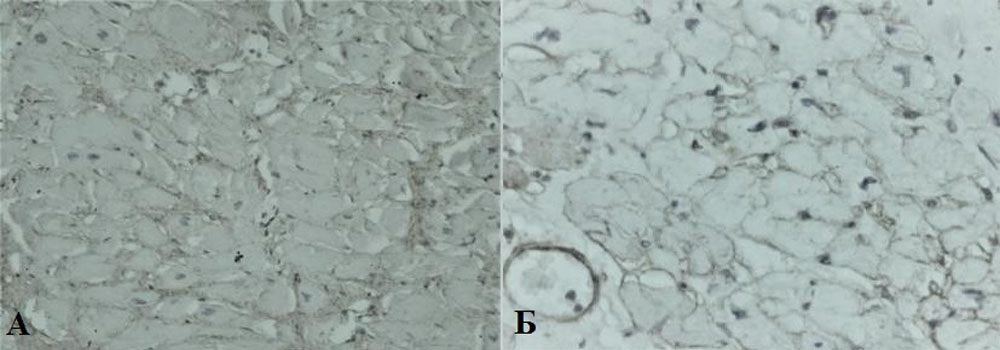
Рисунок 12. Иммобилизирующий интерстициальный фиброз сердца, огрубление соединительной ткани. Коллаген I (А) и III (Б) типов (окраска по Вейгерту, увеличение х400)
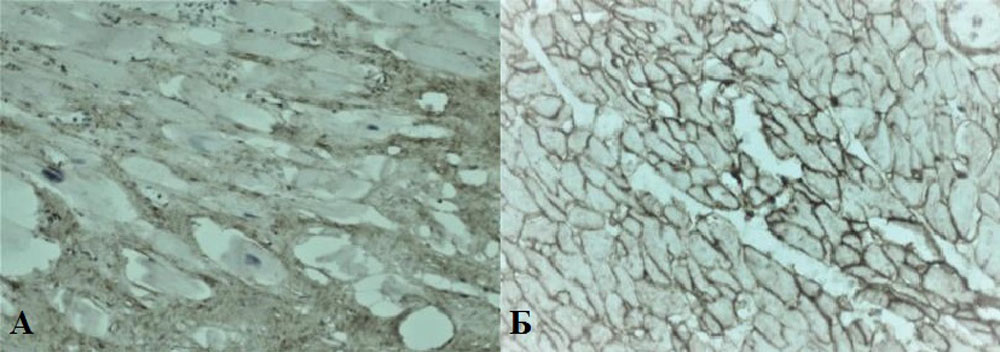
Рисунок 13. Иммобилизирующий интерстициальный фиброз сердца, плотный, грубый соединительнотканный «каркас». Коллаген I (А) и III (Б) типов (окраска по Вейгерту, увеличение х400)
Иммуногистохимическим методом выявлена повышенная экспрессия биологических молекул — матриксных металлопротеиназ (ММР-2 и ММР-9), которые выделяются иммунными клетками и фибробластами интерстициальной ткани сердца и участвуют в перестройке эндомизия и перимизия сердца. Их выделение — это первый этап разрушения нормальной соединительной ткани (рисунки 14,15).
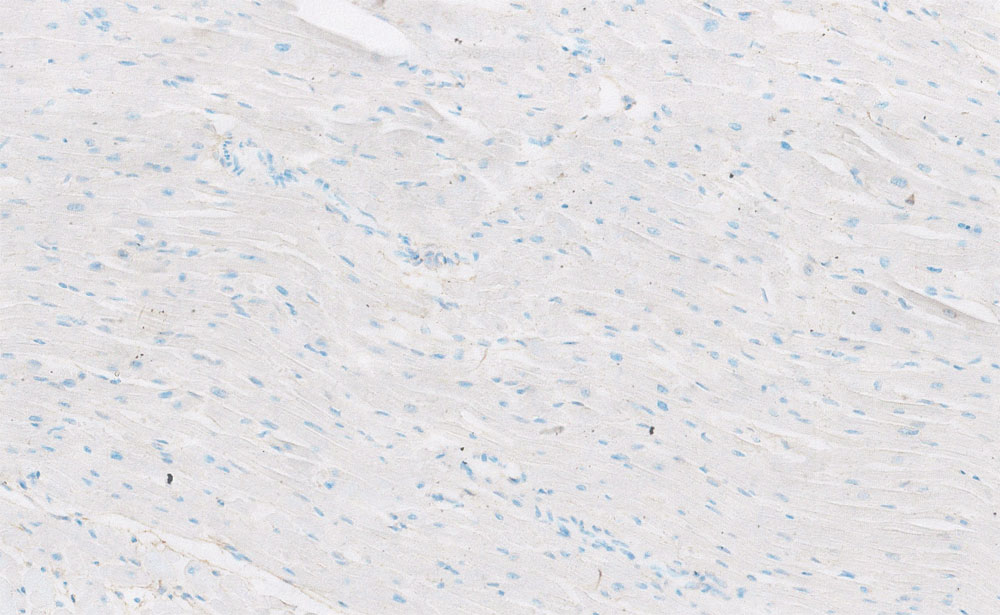
Рисунок 14. Иммобилизирующий интерстициальный фиброз сердца, экспрессия ММР-2 (иммуногистохимический анализ, увеличение х200)
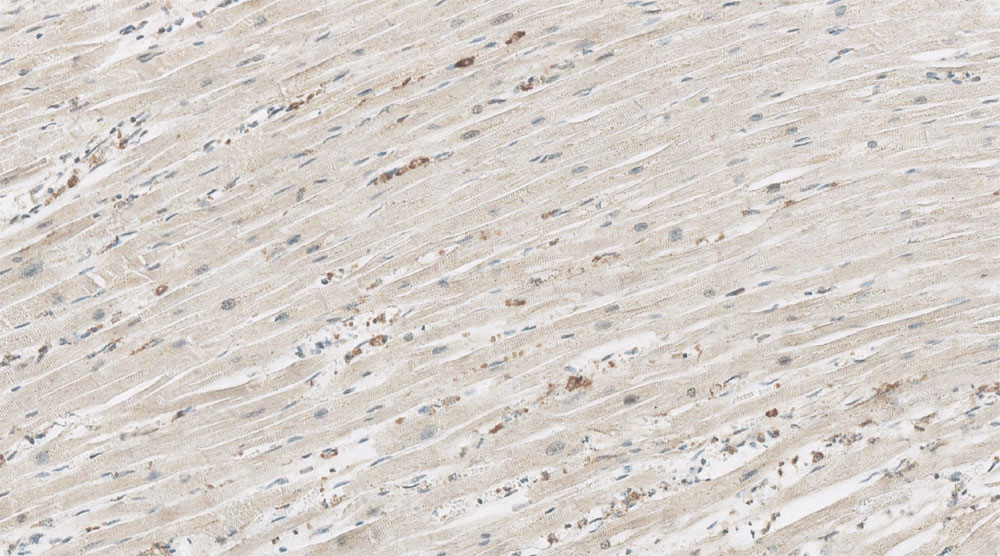
Рисунок 15. Иммобилизирующий интерстициальный фиброз сердца, экспрессия ММР-9 (иммуногистохимический анализ, увеличение х200)
Происходит снижение экспрессии кардиомиоцитами коннексина-4З, являющегося структурной основой щелевых контактов, и его перераспределение в клетке («латерализация») у пациентов с выраженным фиброзом миокарда на фоне увеличения матриксных металлопротеиназ. Это влияет на проводимость и проницаемость для ионов Na+, уменьшается объем импульсов, проходящих через щелевой контакт (рисунок 16).
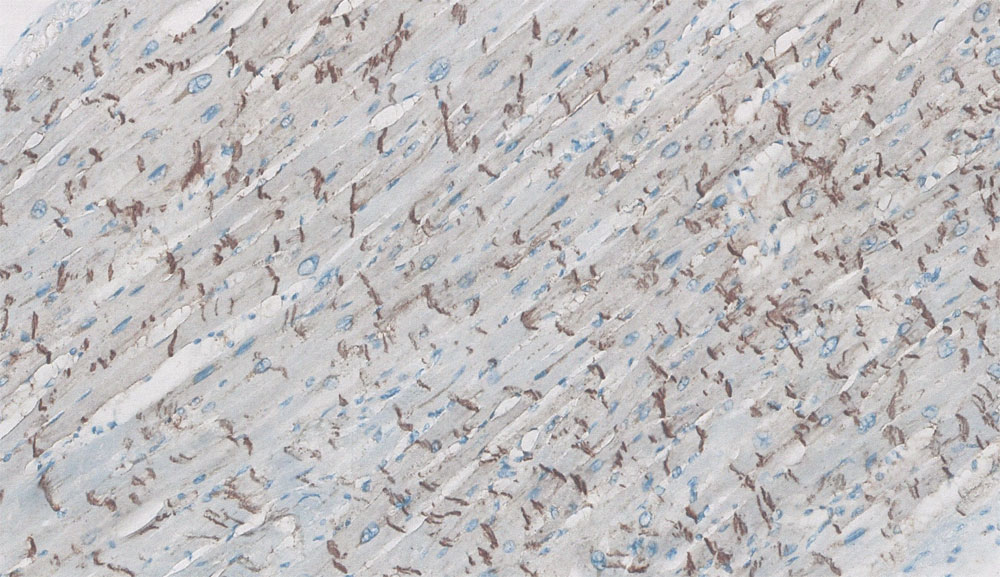
Рисунок 16. Иммобилизирующий интерстициальный фиброз сердца, экспрессия коннексина-43 (иммуногистохимический анализ, увеличение х400)
У пациентов при иммобилизирующем интерстициальном фиброзе происходит изменение структуры индивидуального «оплетения» пучков и отдельных кардиомиоцитов соединительной тканью, увеличивается толщина и плотность «перемычек». При таком изменении межуточной ткани сердца, ее всё большем уплотнении, страдает и лимфатическая система, склерозирование которой приводит к нарушению лимфодренажа (рисунок 17).
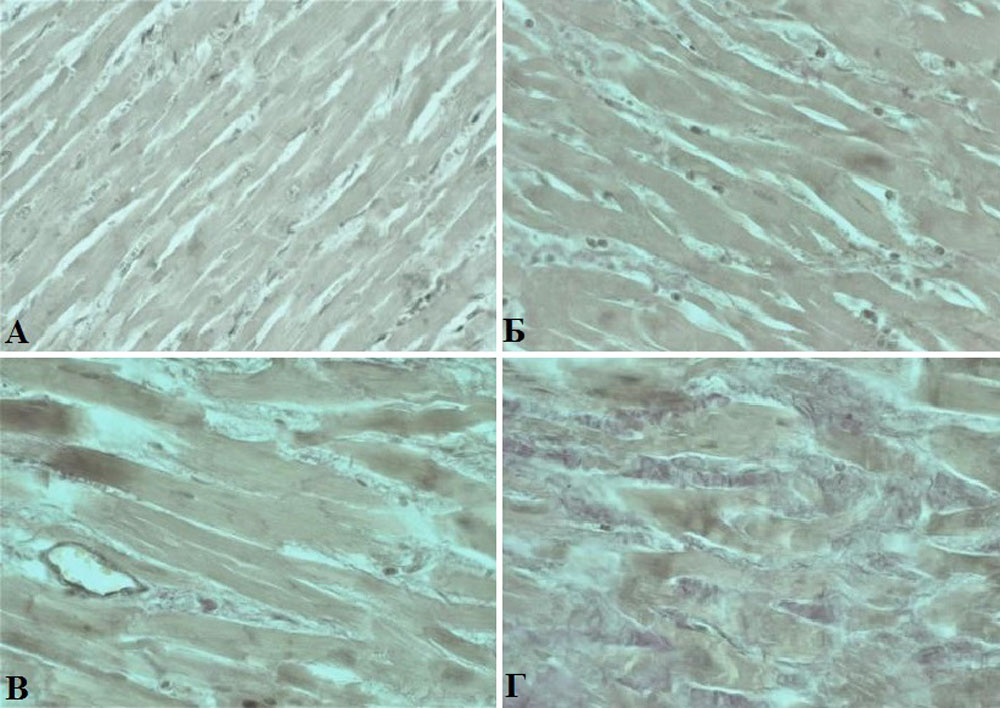
Рисунок 17. Иммобилизирующий интерстициальный фиброз сердца. Постепенное «огрубление» (А-Г) интерстициальной соединительной ткани миокарда (окраска Ван-Гизону, увеличение х400)
Клинические признаки иммобилизирующего интерстициального фиброза сердца
Прежде всего, клиническим проявлением иммобилизирующего интерстициального фиброза является необъяснимая сердечная недостаточность. Малоэффективна, а потом и совсем неэффективна общепринятая кардиотоническая терапия. В результате иммобилизации пучков кардиомиоцитов нарушается диастолическая функция сердца, затем происходит постепенное снижение фракции выброса левого желудочка, появляются признаки застоя по малому, а позже и по большому кругу кровообращения. Медленно прогрессирующая сердечная недостаточность, в итоге, переходит в усугубляющуюся недостаточность общего кровообращения со всеми её клиническими проявлениями: развивается легочная гипертензия, цирроз Пика и полиорганная недостаточность. Правда, до такого состояния пациенты, как правило, не доживают.
Можно выделить следующие стадии развития заболевания:
- латентная стадия, период бессимптомного течения (ранние изменения соединительной ткани);
- стадия первичных скрытых проявлений (умеренная степень фиброза с увеличением коллагена I и III типа);
- стадия диастолической дисфункции (умеренная степень фиброза со значимым преобладанием коллагена I типа);
- систолической и диастолической дисфункции (тяжелая степень фиброза);
- стадия коронарной ангиопатии (тяжелая степень фиброза с вовлечение периферического коронарного русла).
Обращает на себя внимание наличие в анамнезе: ревматических атак, туберкулеза, вирусных инфекций (в том числе SARS-CoV-2), наличие или раннее перенесенных очаговых инфекций (синусит, остеомиелит, пародонтит, нефрит, цистит, пиелонефрит, плеврит и прочее), заболеваний соединительной ткани, лучевой терапии при медиастинальной форме лимфогранулематоза, заболеваний щитовидной железы, сахарного диабета 2 типа, нарушения ритма сердца и проводимости. Необъяснимая сердечная недостаточность в климактерическом периоде, особенно у мужчин, также может свидетельствовать об иммобилизирующем интерстициальном фиброзе сердца. Важным эхокардиографическим и сцинтиграфическим критерием является отсутствие изолированного локального нарушения сократимости миокарда, на фоне снижения глобальной систолической функции сердца в более поздние периоды, в этом заключается отличие от фиброза ишемического генеза (видео
Видео 7. Эхокардиография. Нормальная сократительная способность миокарда (отсутствие зон гипокинеза), общая ФВ ЛЖ сохранена — 64%
Видео 8. Эхокардиография. ИБС, верхушечная постинфарктная аневризма с тромбом. Зона локального акинеза (область постинфарктного кардиосклероза) в области верхушки, общая ФВ ЛЖ — 50%
Видео 9. Эхокардиография. Иммобилизирующий интерстициальный фиброз сердца. Диффузное снижение сократительной способности по всему миокарду ЛЖ. Сократительная способность ЛЖ снижена, общая ФВ ЛЖ — 41%
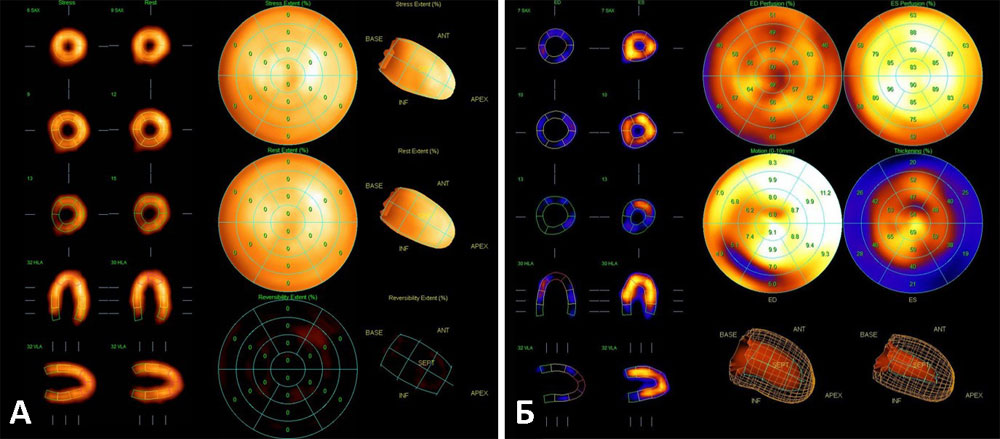
Рисунок 18. Сцинтиграфия миокарда с 99mТс-технетрилом (А — перфузия миокарда ЛЖ, Б — функция миокарда ЛЖ). Пациент А., 56 л. Нормальная миокардиальная перфузия при нагрузке и в покое (отсутствие дефектов перфузии) в сочетании с нормальной сократительной способностью миокарда ЛЖ (отсутствие зон гипокинеза), общая ФВ ЛЖ — 67%
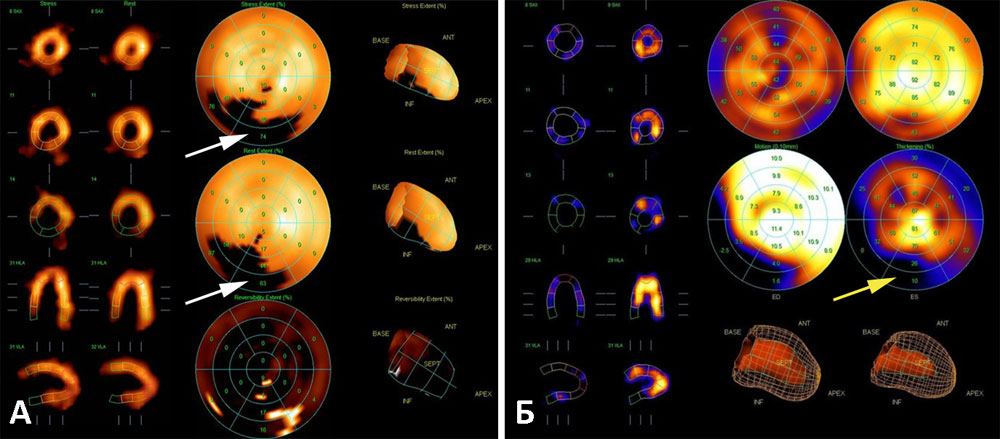
Рисунок 19. Сцинтиграфия миокарда с 99mТс-технетрилом (А — перфузия миокарда ЛЖ, Б — функция миокарда ЛЖ). Пациент А., 72 л. ИБС, постинфарктный кардиосклероз, состояние после стентирования правой коронарной артерии. Зона локальной гипоперфузии (область постинфарктного кардиосклероза) в области задней стенки ЛЖ и задней МЖП (белые стрелки) совпадает с зоной локального гипокинеза (желтая стрелка). Сократительная способность ЛЖ сохранена, общая ФВ ЛЖ — 58%
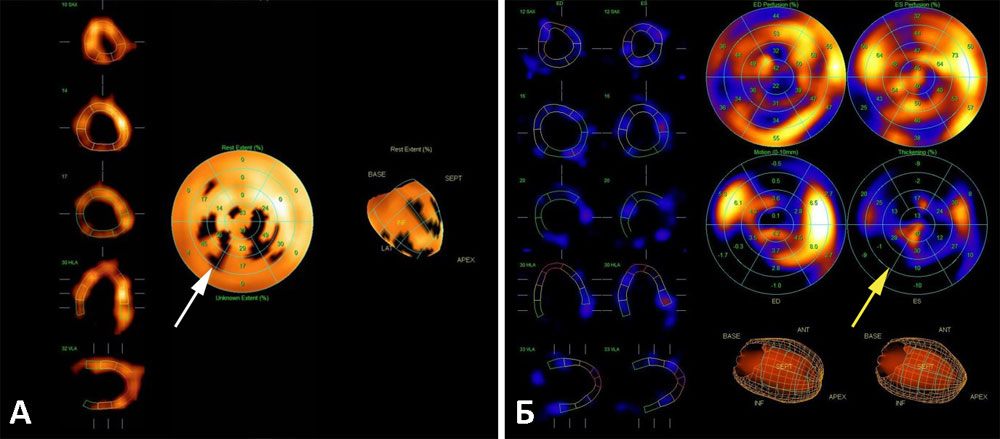
Рисунок 20. Сцинтиграфия миокарда с 99mТс-технетрилом (А — перфузия миокарда ЛЖ, Б — функция миокарда ЛЖ). Пациент А., 49 л., Иммобилизирующий интерстициальный фиброз сердца. Диффузное снижение перфузии (белая стрелка) в сочетании с диффузным снижением регионального систолического утолщения (желтая стрелка) по всему миокарду ЛЖ без четкой дифференциации зон локальной гипоперфузии и локального гипокинеза. ЛЖ значительно увеличен в размерах, полость его расширена. Сократительная способность ЛЖ резко снижена, общая ФВ ЛЖ — 37%
Конечно, прямым диагностическим критерием является морфологическое исследование биоптатов сердца, с тотальным, диффузным поражением соединительной ткани. Однако это исследование не всегда выполнимо и поэтому в диагностике следует учитывать весь комплекс перечисленных признаков. В перспективе не исключается определение наличия металлопротеиназ в крови и выявление других лабораторных маркеров, а также определение плотности межуточной соединительной ткани сердца (эластометрия).
Возможные принципы лечения
Предполагаем, что положительный эффект возможно достичь применением глюкокортикостероидов, но, по-видимому, в относительно ранние сроки развития болезни. Вероятно, перспективным направлением лечения иммобилизирующего интерстициального фиброза сердца будет использование ингибиторов металлопротеиназ. Не исключается использование ультразвуковой ударно-волновой терапии, направленной на уменьшение плотности соединительной ткани за счет разрыва ее волокон. Вполне возможно, что эффективным может быть и применение цитостатических препаратов. При прогрессировании фиброза, на стадиях появления ангиопатии, когда терапия становится совсем неэффективной, по-видимому, будет рассмотрен вопрос о проведении трансплантации сердца, конечно же, при отсутствии необратимых морфологических изменений в других органах. Однако все это требует дальнейших исследований.
Заключение
Итак, иммобилизирующий интерстициальный фиброз сердца можно считать самостоятельной патологией и одной из главных причин развития хронической сердечной недостаточности. В основе его лежит процесс изменения соединительнотканного каркаса миокарда, приводящий в итоге к угнетению его работы. Расшифровка молекулярных и структурных основ «перестройки» соединительной ткани сердца и собственно миокарда при фиброзе является ключом к пониманию патогенетических основ развития некурабельной сердечной недостаточности, не связанной с исходными ишемическими изменениями, врожденными и приобретенными пороками сердца.
В основу предупреждения и лечения иммобилизирующего интерстициального фиброза сердца, по-видимому, должен быть положен принцип борьбы с причинами аутоиммунных процессов в организме и подавления реактивности соединительной ткани сердца.
Список литературы
1. Ricard-Blum S. The collagen family. Cold Spring Harb Perspect Biol. 2011;3(1):a004978. doi: 10.1101/cshperspect.a004978.
2. Halper J. Basic Components of Connective Tissues and Extracellular Matrix: Fibronectin, Fibrinogen, Laminin, Elastin, Fibrillins, Fibulins, Matrilins, Tenascins and Thrombospondins. Adv Exp Med Biol. 2021;1348:105-126. doi: 10.1007/978-3-030-80614-9_4.
3. Pinto AR, Ilinykh A, Ivey MJ, et al. Revisiting cardiac cellular composition. Circ Res. 2016;118:400-409.
4. Gersch C, Dewald O, Zoerlein M, et al. Mast cells and macrophages in normal C57/BL/6 mice. Histochem Cell Biol 2002;118:41-49.
5. Bajpai G, Schneider C, Wong N, et al. The human heart contains distinct macrophage subsets with divergent origins and functions. Nat Med. 2018;24:1234-1245.
6. Epelman S, Lavine KJ, Beaudin AE, et al. Embryonic and adult-derived resident cardiac macrophages are maintained through distinct mechanisms at steady state and during inflammation. Immunity 2014;40:91-104.
7. Lee JS, Jeong SJ, Kim S, et al. Conventional dendritic cells impair recovery after myocardial infarction. J Immunol 2018;201:1784-1798.
8. Camelliti P, Borg TK, Kohl P. Structural and functional characterisation of cardiac fibroblasts. Cardiovasc Res 2005;65:40-51.
9. Tallquist MD. Cardiac fibroblast diversity. Annu Rev Physiol 2020;82:63-78.
10. Liu X, Wu H, Byrne M, et al. Type III collagen is crucial for collagen I fibrillogenesis and for normal cardiovascular development. Proc Natl Acad Sci U S A. 1997;94(5):1852-1856. doi: 10.1073/pnas.94.5.1852.
11. Kuivaniemi H, Tromp G. Type III collagen (COL3A1): Gene and protein structure, tissue distribution, and associated diseases. Gene. 2019;707:151-171. doi: 10.1016/j.gene.2019.05.003
12. Jugdutt BI. Ventricular remodeling after infarction and the extracellular collagen matrix: when is enough enough? Circulation 2003;108:1395-1403.
13. Huang S, Chen B, Su Y, et al. Distinct roles of myofibroblast-specific Smad2 and Smad3 signaling in repair and remodeling of the infarcted heart. J Mol Cell Cardiol 2019;132:84-97.
14. Suthahar N, Meijers WC, Sillje HHW, de Boer RA. From Inflammation to Fibrosis-Molecular and Cellular Mechanisms of Myocardial Tissue Remodelling and Perspectives on Differential Treatment Opportunities. Curr Heart Fail Rep. 2017;14(4):235-250. doi:10.1007/s11897-017-0343-y
15. Krenning G, Zeisberg EM, Kalluri R. The origin of fibroblasts and mechanism of cardiac fibrosis. J Cell Physiol. 2010;225:631-7. doi:10.1002/jcp.22322.
16. Frangogiannis NG. Cardiac fibrosis. Cardiovasc Res. 2021;117(6):1450-1488. doi:10.1093/cvr/cvaa324].
17. Gao XM, White DA, Dart AM, Du XJ. Post-infarct cardiac rupture: recent insights on pathogenesis and therapeutic interventions. Pharmacol Ther 2012;134:156-179.
18. Dai Z, Aoki T, Fukumoto Y, Shimokawa H. Coronary perivascular fibrosis is associated with impairment of coronary blood flow in patients with non-ischemic heart failure. J Cardiol 2012;60:416-421.
19. Kalkman E, Bilgin Y, Haren P, et al. Determinants of coronary reserve in rats subjected to coronary artery ligation or aortic banding. Cardiovasc Res 1996;32:1088-1095.
20. Kramann R, Schneider RK, DiRocco DP, et al. Perivascular Gli1+ progenitors are key contributors to injury-induced organ fibrosis. Cell Stem Cell 2015;16:51-66.
21. Wu L, Ong S, Talor MV, et al. Cardiac fibroblasts mediate IL-17A-driven inflammatory dilated cardiomyopathy. J Exp Med. 2014;211:1449-1464. doi: 10.1084/jem.20132126.
22. Дземешкевич С.Л., Стивенсон Л.У. Дисфункция миокарда и сердечная хирургия: классификация, диагностика, хирургическое лечение – М.: ГЭОТАР-Медиа, 2009. [Dzemeshkevich SL, Stivenson LU. Disfunkciya miokarda i serdechnaya hirurgiya: klassifikaciya, diagnostika, hirurgicheskoe lechenie – M.: GEOTAR-Media, 2009. (In Russ)]
23. Ткаченко С. Б., Берестень Н.Ф. Тканевое допплеровское исследование миокарда. – М.: Реал Тайм, 2006. [Tkachenko S. B., Beresten' N.F. Tkanevoe dopplerovskoe issledovanie miokarda. – M.: Real Tajm, 2006. (In Russ)]
24. Павлюкова Е.Н., Кужель Д.А., Матюшин Г.В., и др. Ротация, скручивание и раскручивание левого желудочка: физиологическая роль и значение в клинической практике. // Рациональная фармакотерапия в кардиологии. – 2015. – Т. 11. – №1. – С. 68-78. [Pavlyukova E.N., Kuzhel' D.A., Matyushin G.V., et al. Rotaciya, skruchivanie i raskruchivanie levogo zheludochka: fiziologicheskaya rol' i znachenie v klinicheskoj praktike. Racional'naya farmakoterapiya v kardiologii. 2015;11(1):68-78. (In Russ)]